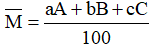Đáp án đúng: A
*Phương pháp giải:
- ta có đông vị 37Cl chiếm 24,23% từ đó sẽ tính ra được %đồng vị 35Cl
- tính khối lượng mol trung bình của Cl trong cả 2 đồng vị
- từ đó tính ra phần trắm của 37Cl trong HClO4
*Lời giải:
Phần trăm đồng vị là 24,23%
→ Phần trăm đồng vị là
100 – 24,23 = 75,77%
MCl = (g/mol)
Phần trăm khối lượng của trong HClO4 là:
% =
* Lý thuyết cần nắm và dạng bài tập về tính phần trắm đồng vị, tính nguyên tử khối trung bình:
Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử.
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu).
- Một cách gần đúng, coi nguyên tử khối có giá trị bằng số khối.
Áp dụng công thức tính nguyên tử khối trung bình:
Với: a, b, c là số nguyên tử (hoặc % số nguyên tử) của mỗi đồng vị.
A, B, C là nguyên tử khối (hay số khối) của mỗi đồng vị.
Xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Cách 2: phương pháp giải nhanh sử dụng đường chéo để làm bài
Xem thêm các bài viết liên quan hay, chi tiết:
Lý thuyết Ôn tập chương 1 – Hóa 10 Kết nối tri thức
Giải Hóa 10 Bài 4 (Kết nối tri thức): Ôn tập chương 1
Trắc nghiệm Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị có đáp án – Hóa học lớp 10